Intelligence artificielle : mieux sélectionner les patients éligibles à une combinaison entre immunothérapie et radiothérapie anticancéreuse
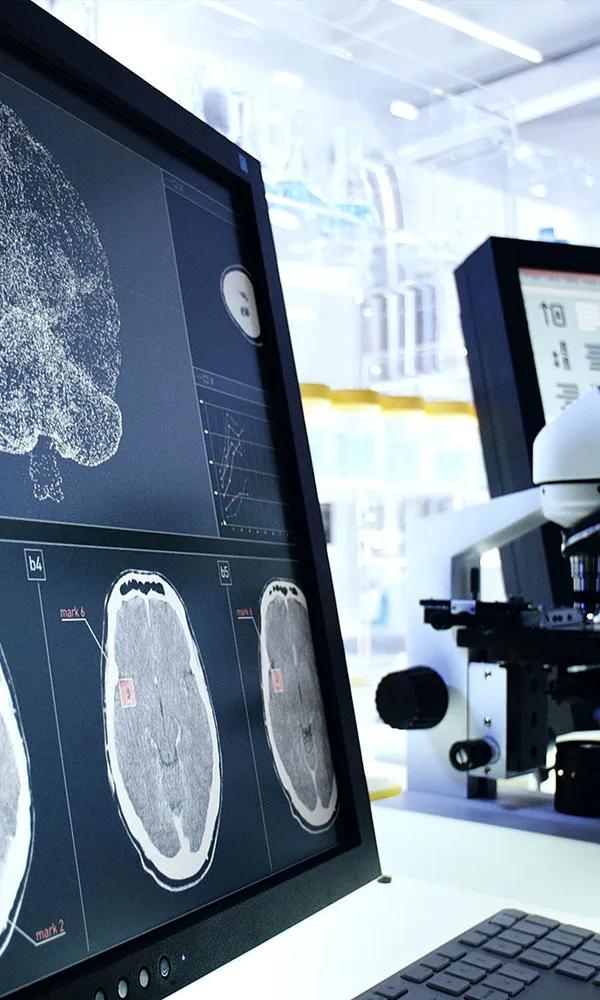
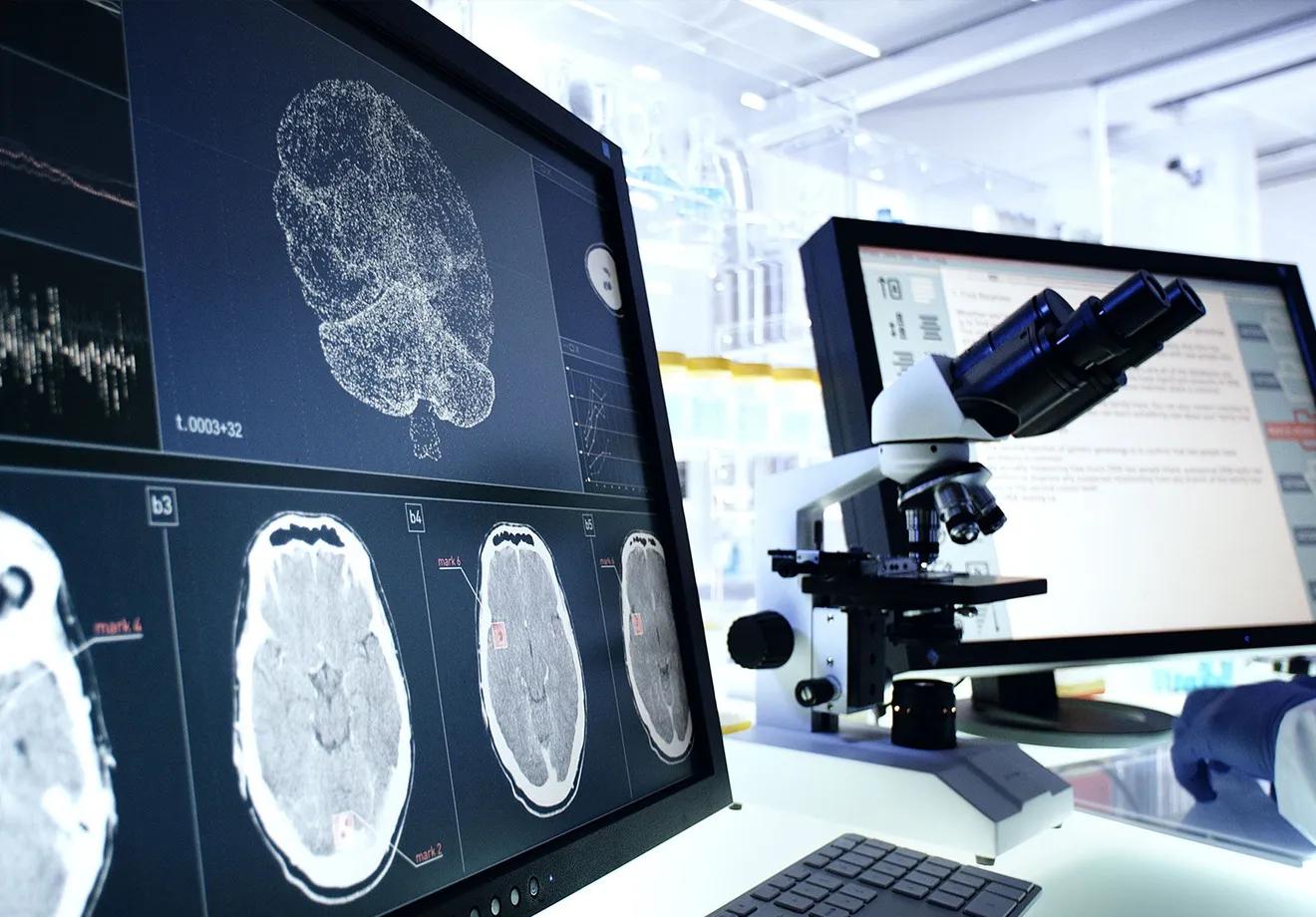
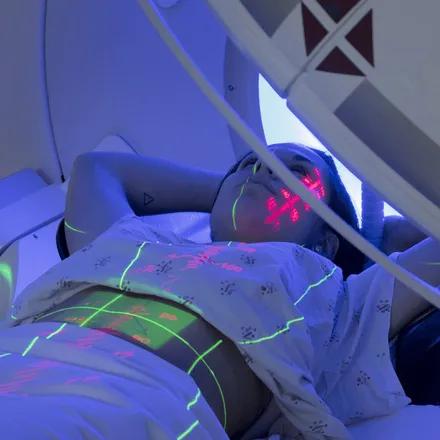
Utilisée chez plus de la moitié des patients atteints de cancer, la radiothérapie est une arme thérapeutique majeure. Elle permet de détruire les cellules tumorales grâce à des rayonnements ciblés, tout en épargnant les tissus sains. Cette technique en constante évolution repose aujourd’hui sur une médecine de précision, et fait l’objet de très nombreuses innovations en recherche.
La radiothérapie est l’un des traitements les plus utilisés en cancérologie.
En France, plus de 214 000 patients sont traités chaque année avec cette méthode, selon l’ Observatoire national de la radiothérapie.
Ce traitement concerne environ 60 % des personnes atteintes d’un cancer au cours de leur parcours de soins, que ce soit à visée curative, palliative ou adjuvante. 3,9 millions de séances de radiothérapie ont eu lieu en 2020 d’après le Ministère de la santé.
La radiothérapie est un traitement locorégional. Il consiste à délivrer localement des radiations dans une tumeur pour la détruire. On parle aussi de rayonnements ionisants ou de rayons. Les radiations interagissent avec la matière vivante en produisant des réactions physico-chimiques qui lèsent le matériel génétique des cellules, l’ADN, empêchant les cellules de se multiplier.
Les cellules tumorales ont une particularité : elles possèdent une capacité de multiplication accrue, ce qui les rend plus sensibles à la radiothérapie que les cellules saines. Elles sont donc détruites de manière préférentielle. Elles possèdent de plus des capacités de réparation moindres.
Les thérapies anticancéreuses suscitent souvent beaucoup d’appréhension, d’autant plus la radiothérapie, qui utilise des rayons ionisants. Il est essentiel de rétablir le vrai du faux pour rassurer les patients et leurs proches.
Ces dernières années, la radiothérapie a grandement évolué, en parallèle des progrès réalisés dans le domaine de l’imagerie médicale. À ses débuts, les possibilités de localiser précisément les tumeurs étaient limitées, ce qui compliquait l’administration ciblée de rayonnements. Les praticiens devaient alors s’appuyer sur des repères anatomiques approximatifs pour estimer la zone à traiter, au risque d’irradier inutilement des tissus sains.
Dès la fin des années 1990, l’arrivée de logiciels de planification plus puissants et d’outils d’imagerie avancés comme le scanner, l’IRM et la TEP, a permis de mieux visualiser les tumeurs et d’adapter finement les doses de rayonnement. Cette évolution a marqué l’entrée dans l’ère de la radiothérapie conformationnelle, capable de moduler l’intensité du rayonnement et d’épouser la forme tridimensionnelle de la tumeur. Des progrès informatiques et matériels importants ont aussi permis de mieux calculer les doses de rayons à délivrer, et surtout, de les administrer avec une plus grande précision.
Sur le plan technique, les sources de rayonnement ont elles aussi considérablement évolué. Le radium, utilisé historiquement, a été progressivement remplacé dans les années 1950 par le cobalt 60. Puis, dans les années 1970-1980, les accélérateurs linéaires de particules se sont imposés comme la technologie de référence, permettant de générer des rayons X de haute énergie avec un contrôle beaucoup plus fin de leur distribution.
Aujourd’hui, la radiothérapie moderne permet une précision millimétrique, avec des techniques comme la radiothérapie guidée par l’image (IGRT) ou la modulation d’intensité (IMRT), offrant des traitements plus efficaces et mieux tolérés par les patients.
Le recours à la radiothérapie dépend de plusieurs critères médicaux, évalués de façon individualisée. La taille de la tumeur, sa localisation et son stade d’évolution, l’âge du patient, son état général et la présence d’autres traitements en cours, notamment de chirurgies ou chimiothérapies, entrent en compte dans la stratégie thérapeutique.
La radiothérapie peut être utilisée à différents moments du parcours de soins : en traitement curatif, pour détruire une tumeur localisée, en traitement adjuvant, après une chirurgie, pour éliminer les cellules cancéreuses résiduelles, ou encore en traitement néoadjuvant, c’est-à-dire avant une opération, pour réduire la taille de la tumeur et faciliter son ablation. Dans d’autres cas, la technique est employée en traitement palliatif, pour soulager la douleur ou réduire des symptômes gênants, comme une compression neurologique, en particulier dans les cancers à un stade avancé.
La radiothérapie moderne est une discipline de haute précision, reposant sur un travail en équipe entre radiothérapeutes, manipulateurs, et radiophysiciens médicaux. Le radiophysicien médical joue un rôle clé : il calcule rigoureusement les doses nécessaires, en fonction des caractéristiques de la tumeur et des organes à risque à proximité, et vérifie tous les réglages de la machine pour garantir un traitement optimal.
Grâce à l’imagerie en temps réel et à la planification 3D, chaque séance est ajustée au millimètre près. Cela permet d’optimiser le contrôle de la tumeur, tout en limitant les effets secondaires sur les tissus sains. La radiothérapie moderne est donc une médecine ultra-personnalisée, intégrée dans une stratégie globale de soins adaptée aux besoins de chaque patient, à chaque étape de la maladie.
C’est la technique la plus utilisée actuellement. Elle réside en une combinaison de plusieurs faisceaux de rayonnement, ce qui permet une distribution très précise et adaptée aux contours de la tumeur. Elle permet ainsi de mieux épargner les tissus sains qui avoisinent la zone irradiée. Grâce à la planification 3D et aux systèmes de contrôle en temps réel, la radiothérapie conformationnelle à modulation d’intensité offre une excellente balance entre efficacité thérapeutique et limitation des effets secondaires.
La radiothérapie stéréotaxique est une technique de haute précision permettant d’irradier à haute dose de très petits volumes. Elle est ainsi utilisée pour les tumeurs de petite taille, habituellement jusqu’à 2 - 3 cm de diamètre, et situées à proximité de structures sensibles comme dans le cerveau, le foie ou la colonne vertébrale. Son extrême précision (< 1 mm) permet une irradiation ciblée, souvent en quelques séances seulement, avec un risque réduit pour les tissus voisins.
Certaines tumeurs thoraciques, notamment pulmonaires ou mammaires, se déplacent avec les mouvements respiratoires. La radiothérapie asservie à la respiration permet de synchroniser l’émission des rayons avec la respiration du patient, pour n’irradier la tumeur que lorsqu’elle est dans la position idéale. Cette technique augmente la précision du traitement tout en préservant les structures saines comme le cœur ou les poumons.
La curiethérapie est une technique historique de radiothérapie interne. Elle consiste à implanter directement des sources radioactives à l’intérieur ou au contact immédiat de la tumeur. La curiethérapie est couramment utilisée dans les cancers gynécologiques, de la prostate ou ORL. Elle permet d’irradier à forte dose une zone très localisée, tout en épargnant les tissus avoisinants, car l’intensité du rayonnement décroît très rapidement avec la distance.
Cette technique de radiothérapie externe utilise des faisceaux de protons, au lieu des photons pour la radiothérapie classique. Cela a pour intérêt de délivrer la juste dose de rayons, et ce à une profondeur de tissu donnée. Sa précision est inférieure au millimètre, ce qui permet la prise en charge de tumeurs peu accessibles, de la tête et du cou.
L’hadronthérapie est une technique de radiothérapie innovante qui utilise des faisceaux d’ions chargés positivement, notamment des ions hydrogènes ( protons ) ou carbone. Ici aussi, l’intérêt de la méthode est sa précision, qui permet une destruction maximale des cellules tumorales tout en préservant les tissus sains environnants. L’hadronthérapie est une technique prometteuse pour traiter des tumeurs résistantes aux rayons classiques ou très mal localisées.
Avant de commencer le traitement, une première séance de repérage ou de simulation est organisée. Elle inclut un scanner dédié à la radiothérapie, parfois complété par une IRM, afin de localiser exactement la tumeur et les organes à protéger. Cette étape permet de définir les volumes à traiter, d’identifier les tissus sains à épargner et de calculer la dose de rayons à administrer avec précision, en fonction de la nature de la tumeur et de sa radiosensibilité. Des marqueurs cutanés temporaires ou tatouages peuvent être posés pour garantir un positionnement reproductible du patient à chaque séance. Un système de contention, tel qu’un coussin ou un masque, est parfois envisagé pour éviter les mouvements.
La radiothérapie débute quelques jours après la phase de planification. Le traitement s’échelonne généralement sur plusieurs semaines, à raison d’une séance par jour, cinq jours par semaine. Chaque séance dure entre 10 et 30 minutes, temps d’installation du patient inclus, mais l’irradiation en elle-même ne prend que quelques minutes. La stratégie repose sur le fractionnement des doses : plutôt que d’administrer une forte dose en une seule fois, de petites doses quotidiennes sont délivrées pour cumuler l’effet sur les cellules tumorales, tout en laissant le temps aux tissus sains de se régénérer entre les séances.
La radiothérapie est un traitement localisé, ce qui signifie que ses effets secondaires dépendent essentiellement de la région du corps irradiée, de la dose reçue et du type de technique utilisée.
Les effets secondaires les plus fréquents de la radiothérapie surviennent pendant ou juste après le traitement. Il peut s’agir de rougeurs ou d’irritations cutanées comparables à un coup de soleil, de fatigue accrue, ou de réactions au niveau des muqueuses, par exemple des aphtes, une sécheresse et des diarrhées selon la zone irradiée. En général, ces effets sont transitoires et disparaissent dans les semaines qui suivent la fin du traitement.
Après une radiothérapie, certains patients peuvent ressentir des effets différés, plusieurs mois, voire plusieurs années après le traitement. Ceux-ci dépendent toujours de la zone concernée. Ils peuvent inclure des troubles de la fertilité, une sécheresse chronique de la bouche et du vagin, une fibrose locale ou une modification de la peau durable. Dans de rares cas, des complications plus graves peuvent survenir, comme une atteinte des organes proches ou des douleurs persistantes. Des effets secondaires très tardifs, comme l’apparition d’un second cancer dans la zone traitée, restent exceptionnels mais possibles.
Grâce aux progrès constants de la radiothérapie, les effets secondaires aigus sont maintenant mieux anticipés et moins fréquents. Les troubles cutanés, les lésions des muqueuses ou les alopécies, correspondant à la chute des cheveux ou des poils, peuvent encore survenir, mais sont le plus souvent modérés et réversibles. Ils disparaissent habituellement dans les semaines qui suivent la fin du traitement, et leur intensité dépend de la zone irradiée, de la dose totale et de la sensibilité individuelle des patients.
Un suivi médical est assuré tout au long du protocole, permettant d’adapter si nécessaire la prise en charge des effets secondaires ou de réajuster la stratégie thérapeutique. Des soins de support, incluant nutrition, kinésithérapie, soins dermatologiques et soutien psychologique, sont également proposés dans la majorité des centres pour améliorer la qualité de vie des patients pendant et après la radiothérapie.
Les chercheurs étudient des solutions d’hypofractionnement, consistant à irradier plus fortement, mais sur un nombre réduit de séances, voire une seule séance au moment même de la chirurgie. On parle dans ce cas de « radiothérapie peropératoire ». Cette stratégie constitue une piste prometteuse pour diminuer le poids du traitement pour les patients. Des études cliniques ont montré que, dans le cadre du cancer du sein, elle n’est pas moins efficace, ni plus risquée.
L’intelligence artificielle est aussi de la partie. Des programmes informatiques sont développés spécifiquement pour différents aspects de la prise en charge comme l’aide au diagnostic et la prise de décision thérapeutique. L’intelligence artificielle permet par exemple de délimiter avec précision les volumes à irradier à partir de données d’imagerie médicale et d’anatomopathologie. Elle est aussi utilisée pour adapter la radiothérapie à l’hétérogénéité des tumeurs, ou encore identifier les patients les plus à même de répondre aux traitements, orientant la prise en charge.
Des équipes de recherche travaillent sur le développement de molécules radio-sensibilisantes, telles que les nanoscintillateurs, pour augmenter les effets des rayons de la radiothérapie, sans endommager les tissus sains. D’autres travaux visent à combiner différentes sources de rayons, comme les neutrons et le bore, avec le même objectif. Aussi, un projet est en cours pour montrer l’efficacité augmentée d’une forme de radiothérapie hypofractionnée appelée FLASH-VHEE, délivrant de très hautes doses de rayons en un temps très court, moins de 100 millisecondes (FLASH), à l’aide d’un irradiateur de faisceaux d’électrons de très hautes énergies (VHEE). Enfin, des stratégies tentent de coupler radiothérapie et immunothérapie, afin de modifier la réponse immunitaire naturelle de l’organisme, en la stimulant ou au contraire, en la diminuant.
Newsletter
Restez informé(e) !
Abonnez-vous pour recevoir les actualités et communications de la FRM, les projets et découvertes sur toutes les maladies…
Avec la FRM, votre don est un espoir de guérison
Soutenez les projets de recherche les plus prometteurs.
Intelligence artificielle : mieux sélectionner les patients éligibles à une combinaison entre immunothérapie et radiothérapie anticancéreuse


Radiothérapie : une technique associant neutrons et bore pour une plus grande efficacité et une plus grande sureté
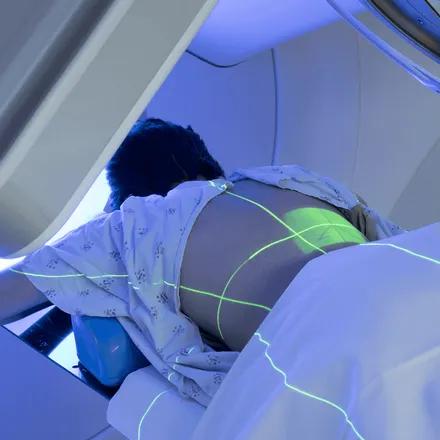
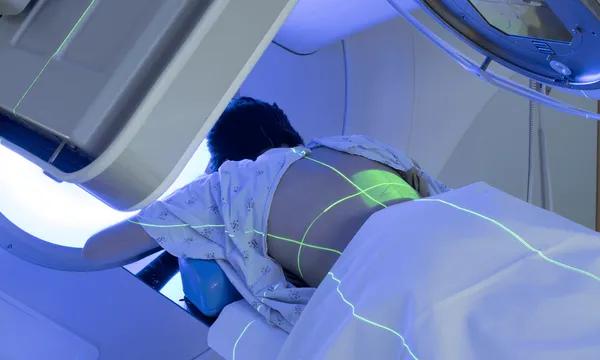
Radiothérapie : des nanoscintillateurs prometteurs pour augmenter l’effet des traitements

Cancers
