Maladie d’Alzheimer : des cibles thérapeutiques potentielles identifiées
24 septembre 2018
01
Cette découverte a été réalisée par Patricio Opazo dans l'équipe « Dynamique de l'organisation et des fonctions synaptiques » dirigée par Daniel Choquet à l'Institut interdisciplinaire des neurosciences, à Bordeaux.
Somme accordée à Patricio Opazo en 2008 dans le cadre d'un stage post-doctoral.
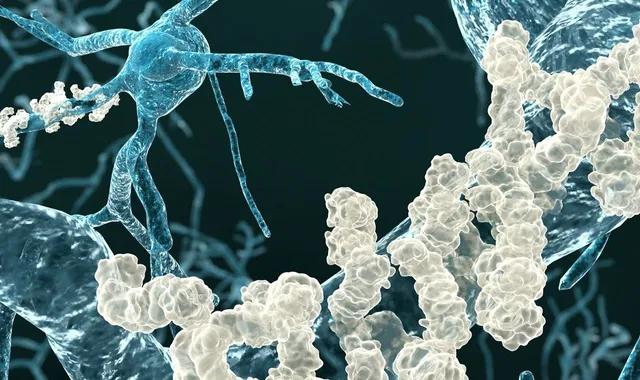
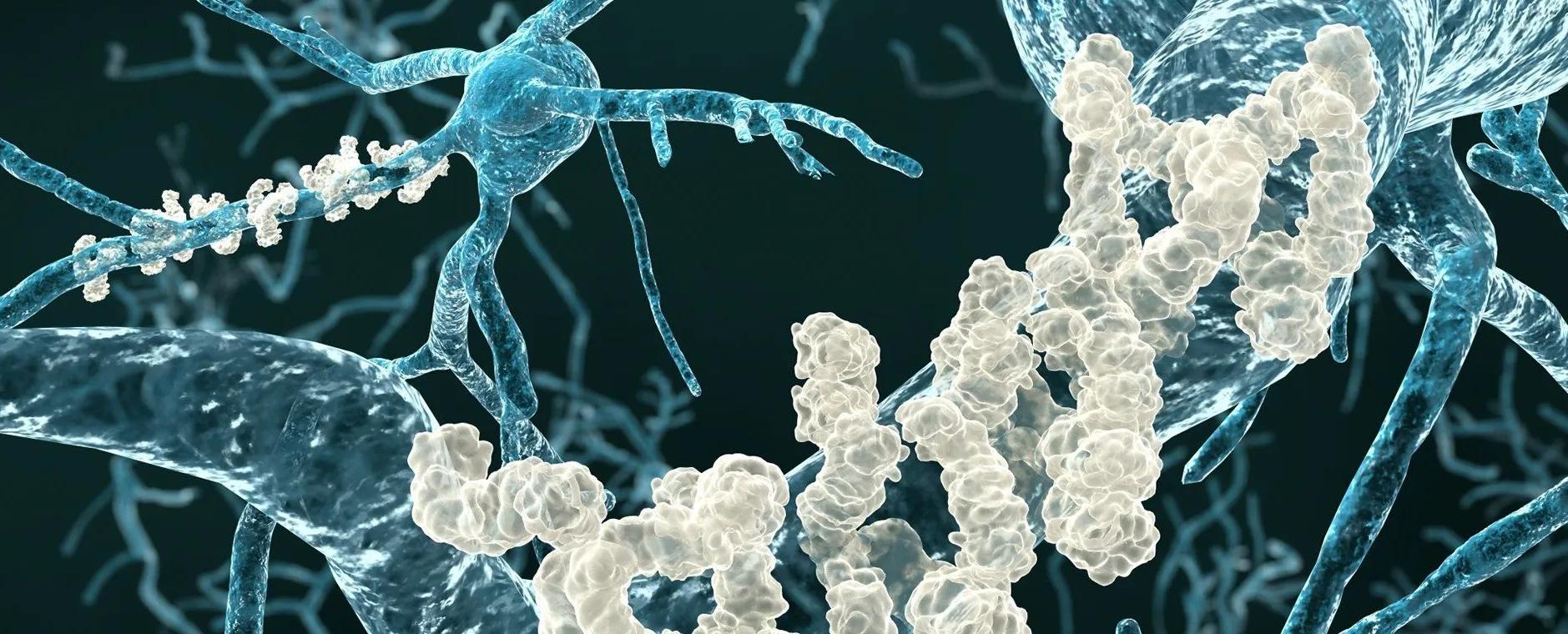
La maladie d'Alzheimer est caractérisée par l'accumulation de peptides amyloïdes dans certaines zones du cerveau.
Jusquà présent, on ne savait pas par quel mécanisme ces peptides affectaient le fonctionnement cérébral et l'acquisition de nouveaux souvenirs.
Des chercheurs français ont montré que ces peptides pourraient avoir une action directe sur les phénomènes moléculaires impliqués dans la mémorisation.
02
La maladie d'Alzheimer est la première maladie neurodégénérative dans l'hexagone : elle toucherait actuellement 900 000 personnes, et près de 225 000 nouveaux cas sont dépistés chaque année. Cette pathologie est caractérisée par une perte neuronale progressive, qui induit en premier lieu des troubles de la mémoire puis du langage et du comportement. Ces troubles conduisent irrémédiablement les patients à la dépendance. Pour le moment, il n'existe pas de traitement curatif de la maladie d'Alzheimer, et les seules mesures qui semblent efficaces sont préventives. Pour découvrir de nouvelles pistes thérapeutiques, les chercheurs étudient les mécanismes fondamentaux impliqués dans la pathologie.
La maladie d'Alzheimer est notamment caractérisée par l'accumulation dans le cerveau de peptides amyloïdes, à l'origine des « plaques amyloïdes ». Ces plaques affecteraient le fonctionnement cérébral et participeraient à la mort neuronale.
Seulement, leur action exacte au niveau moléculaire reste méconnue.
Des chercheurs français ont récemment avancé sur ce point en mettant en évidence un processus moléculaire qui participerait au développement de la maladie et dans lequel les peptides amyloïdes seraient impliqués.
Pour comprendre leur découverte, il faut revenir sur un mécanisme cérébral particulier à la base des processus de mémorisation. La mémorisation résulte d'une activation répétée et régulière d'un même réseau de neurones par des stimulations extérieures. Cela engendre des modifications des connexions entre neurones, appelées synapses : on parle de plasticité synaptique. Cela se traduit notamment par la création de nouvelles connexions, mais aussi par la destruction de certaines d'entre elles. La structure du réseau neuronal se transforme, et le souvenir est stocké de manière durable.
Le phénomène de plasticité synaptique est régulé par une enzyme, CamKII. En cas de stimulation intense, il faut davantage de connexions entre deux neurones adjacents : CamKII induit une augmentation de l'activité des synapses. C'est ici qu'intervient la découverte des chercheurs : les peptides amyloïdes empêchent CamKII d'agir. Son blocage entraîne alors la disparition de la synapse. L'équipe pense que cette étape pourrait intervenir dans les phases précoces de la maladie d'Alzheimer : si ces résultats se confirment, empêcher l'interaction entre CamKII et les peptides amyloïdes pourrait s'avérer une stratégie prometteuse pour lutter contre le développement de la maladie.
Source : Communiqué de presse CNRS, Opazo P et al. CaMKII Metaplasticity Drives Aß Oligomer-Mediated Synaptotoxicity. Cell Rep 2018 ; 23 : 3137-45.
03


Maladies neurologiques et psychiatriques

Science ouverte
Découvrez les publications scientifiques en libre accès, liées aux projets financés par la FRM